.
Aumenta la espera promedio de pacientes por terapias o medicamentos innovadores en la región

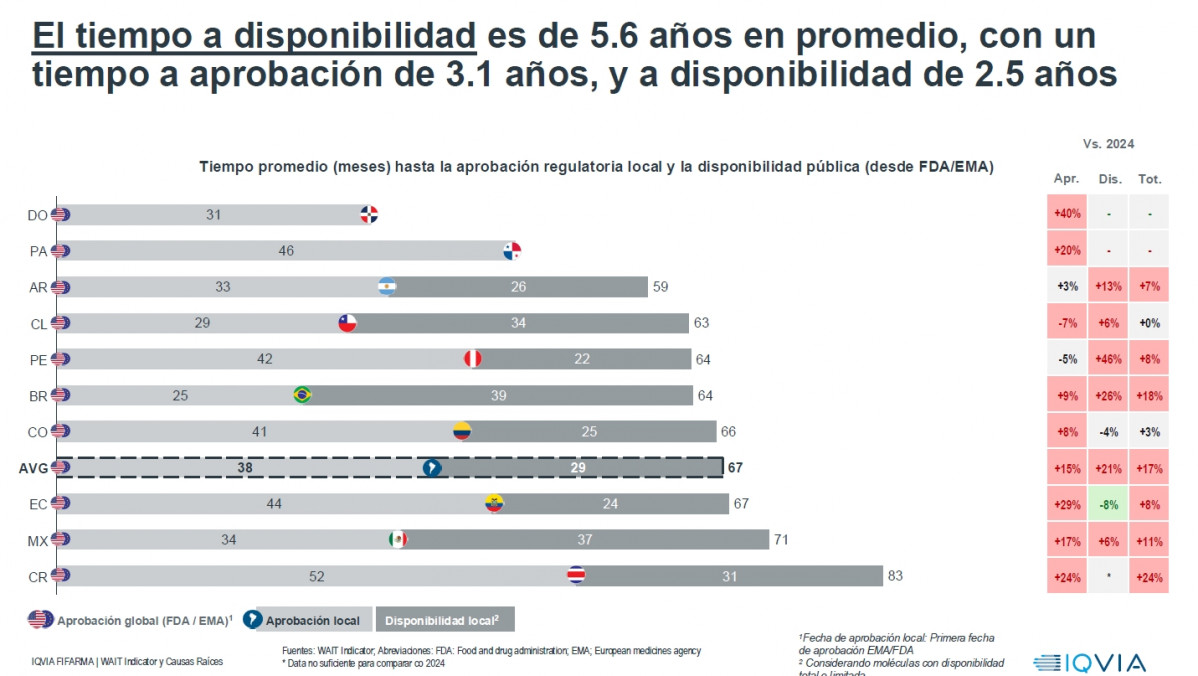
SANTO DOMINGO, RD/ REDACCION DE SALUD.- En Costa Rica, Guatemala, Panamá y República Dominicana, al igual que muchos países de la región latinoamericana, pacientes deben esperar en promedio 5,6 años para contar con las terapias más innovadoras para tratar sus enfermedades. Así lo registra el índice WAIT 2025, que revela un aumento en la espera comparado con el año anterior, cuando el tiempo era en promedio 4.7 años.
El índice incluye el tiempo desde la aprobación internacional hasta la disponibilidad para acceder localmente a nuevas terapias o de última generación. En su edición 2025, incluyó 403 medicamentos para cinco áreas terapéuticas: oncología, enfermedades huérfanas o raras, inmunológicas e inflamatorias, sistema nervioso central y cardiometabólicas. Las terapias fueron aprobados por la FDA, Administración de Alimentos y Medicamentos de los Estados Unidos y EMA, la Agencia Europea de Medicamentos, entre 2014 y 2024.
El estudio identifica a República Dominicana con 31 meses de espera con un tiempo de aprobación de uso del medicamento, pero con datos insuficientes para medir el tiempo total de disponibilidad. El tiempo promedio de aprobación de un medicamento en América Latina es de 38 meses, por lo que República Dominicana estaría por debajo del promedio.
También, el estudio identifica a Costa Rica como el país con los tiempos de aprobación regulatoria más extensos, en contraste con Brasil y Chile, que presentan los plazos de aprobación más eficientes en la región. El promedio de espera total de disponibilidad en los países latinos es de 67 meses, mientras que en Costa Rica es de 83 (6 años y 9 meses).
Esta podría ser solo la punta del iceberg, es decir, lo que pasa con el primero de los tratamientos necesarios en una cadena de terapias requeridas. “Los pacientes de América Latina tienen acceso a menos de la mitad de los medicamentos innovadores disponibles a nivel mundial en el sector privado, y esa tendencia se agrava cuando se observa el sector público, donde están cubiertos la mayoría de pacientes”, describe el estudio.
Además, de la accesibilidad está la disponibilidad de un medicamento, que de acuerdo con WAIT, representa el reembolso local de un medicamento innovador aprobado a nivel mundial.
Para Carmen Da Silva, Directora Clúster Fedefarma para República Dominicana y Panamá “Más allá de los números, este estudio nos ayuda a comprender las causas detrás de estas brechas: procesos regulatorios lentos, ausencia de mecanismos de reembolso ágiles y retos logísticos en los sistemas de salud. En Fedefarma por años hemos venido hablando de los acuerdos de compras gestionadas y tenemos avances recientemente en República Dominicana y Panamá.Sin embargo, falta mucho camino por recorrer y por eso, reafirmamos nuestro compromiso de trabajar de la mano con los diferentes actores del sector salud para transformar estos hallazgos en propuestas concretas que impulsen un entorno regulatorio más eficiente, sostenible y verdaderamente centrado en el paciente”
De acuerdo con el estudio, el panorama no es alentador, con la creciente innovación clínica, las agencias reguladoras y de evaluación de tecnologías sanitarias podrían tener cada vez más atrasos en las evaluaciones. Además,
COVID-19 dejó afectó presupuestariamente a los sistemas de salud.
“América Latina ha demostrado que tiene el talento, la infraestructura y el potencial para liderar en investigación clínica y apertura a la innovación. Pero ese progreso solo será significativo si va acompañado de políticas que garanticen acceso equitativo. En FIFARMA creemos que crecer como industria no basta: el verdadero impacto ocurre cuando la innovación llega a todos los pacientes, sin importar en qué país o región se encuentren”, concluyó Yaneth Giha, directora ejecutiva de FIFARMA.
Los pacientes en la región esperan en promedio 5,6 años para acceder a un tratamiento innovador: 3,1 años para su aprobación local y 2,5 años adicionales para su disponibilidad. Además, el 91 % de las terapias no registraron mejoras frente a 2024, lo que refleja una necesidad de dinamizar los sistemas de acceso.
De los 403 medicamentos aprobados por la FDA y la EMA entre 2014 y 2024, solo el 44 % está autorizado en algún país de América Latina y tan solo el 33% está disponible en el sector público.
Menos del 10% de los medicamentos analizados mejoró su disponibilidad en la región, mientras que el 90% no registró ningún avance y mantuvo el mismo nivel de acceso que en el año 2024.
El estudio identifica a Costa Rica como el país con los tiempos de aprobación regulatoria más extensos, en contraste con Brasil y Chile, que presentan los plazos de aprobación más eficientes en la región.
Recomendaciones para acortar los tiempos de espera
Promover la coordinación entre procesos regulatorios, de evaluación y financiamiento para fortalecer la eficiencia del sistema y facilitar un acceso más oportuno e integral a tratamientos innovadores.
Fomentar espacios de diálogo multisectorial y sostenido que articulen a autoridades, profesionales de la salud, academia, pacientes e industria, impulsando una incorporación más ágil y equitativa de la innovación.
Avanzar hacia marcos regulatorios más transparentes y previsibles, que generen confianza, fortalezcan la planificación estratégica y favorezcan la sostenibilidad del acceso.
Diseñar políticas públicas centradas en el paciente y financieramente sostenibles, con especial atención a áreas prioritarias como el cáncer y las enfermedades raras, promoviendo la equidad en el acceso a terapias innovadoras.
Acerca de WAIT
EI índice W.A.I.T. (Waiting to acces for innovative therapies) es un estudio elaborado por IQVIA y FIFARMA, que analiza la disponibilidad y el tiempo de acceso a 403 medicamentos innovadores para 5 áreas terapeúticas. Representan el 80% de los nuevos medicamentos aprobados mundialmente entre 2014 y 2024.
Esta es la cuarta edición del WAIT en América Latina. La investigación abarca 10 países de la región: Argentina, Brasil, Chile, Colombia, Costa Rica, Ecuador, México, Panamá, Perú y República Dominicana cubriendo así más del 80% de la población total de Latinoamérica.
Acerca de Fedefarma
La Federación Centroamericana y del Caribe de Laboratorios Farmacéuticos, FEDEFARMA, es una entidad gremial creada en la década de los años 70 y agrupa en su seno a la mayoría de las compañías farmacéuticas de investigación y desarrollo que comercializan sus productos en la región de América Central y el Caribe.
Impulsa el acceso a medicamentos innovadores y de alta calidad que contribuyan a mejorar la salud de vida los pacientes y la calidad de vida de la población, a la vez que promueve la sostenibilidad de los sistemas de salud. Fomenta un entorno de libre competencia y de respeto a la propiedad intelectual, dentro de los más altos estándares éticos.